Определить жесткость воды можно, опираясь на ее вкус, запах и степень прозрачности, но в случаях, когда возникают сомнения в этих параметрах, рекомендуется провести анализ в профессиональной лаборатории для получения точных результатов.
Что такое жесткость в воде
Проблемы очистки воды в домашних условиях и на рабочих местах могут быть решены с помощью множества различных методик и специализированного оборудования. Один из самых трудных вопросов заключается в том, насколько высок показатель жесткости воды и как можно понизить его до приемлемых значений. Даже с доступными системами фильтрации это может оказаться непростой задачей. Высокий уровень растворимых солей отрицательно влияет не только на здоровье человека, но и на бытовую технику, а также выдвигает требования к очистным системам, что делает тему жесткости воды актуальной и важной.
Жесткость воды представляет собой атрибут ее качества, который в значительной степени определяет физико-химические свойства вещества и сферу его использования. В данной статье подробно рассматриваются причины жесткости воды, а также проводятся различия в свойствах жидкости в зависимости от содержания солей. Также уделяется внимание требованиям к качеству воды и существующим методам умягчения, применяемым как в быту, так и в профессиональной сфере.
Что такое жесткость воды
Оксид водорода, более известный как вода, является самой распространенной жидкостью на планете и обладает уникальными свойствами растворителя для большинства химических элементов и соединений. Под жесткостью воды понимают количественную меру концентрации щелочноземельных солей и металлических соединений, в основном состоящих из соединений кальция и магния.
Термин «общая жесткость воды» возник благодаря наблюдениям за состоянием текстиля после стирки. Структура ткани, состоящая из различных материалов, подвержена накоплению вышеназванных металлов. При высоком их содержании ткань становится жесткой и грубой, что может оказывать негативное влияние на комфорт использования. Также было установлено, что высокие концентрации этих соединений могут существенно снижать эффективность моющих средств.
Жесткость воды формируется за счет присутствия солей кальция и магния, которые способны образовывать отложения на внутренних поверхностях теплообменных устройств и нагревателей, что снижает эффективность работы системы отопления и может привести к ее поломке. В некоторых ситуациях трубы могут забиваться, что делает их непригодными для дальнейшего использования. Важно понимать, как определить уровень жесткости воды, поступающей в ваш дом, и его возможные последствия.
Основные причины образования жесткости воды
Процесс жесткости воды объясняется тем, что она действует как универсальный растворитель, взаимодействуя с почвой и минералами и насыщаясь содержимыми в них веществами и химическими соединениями. Для понимания вопроса о жесткости и ее причинах следует отметить несколько основных источников солей щелочноземельных металлов:
- Для подземных источников, таких как артезианские скважины, основным источником служат пласты известняка, через которые просачивается вода.
- Для открытых водоемов и приповерхностных слоев воды это могут быть разнообразные геологические породы, включая природный гипс и доломит.
- Ионы кальция и магния попадают в водные источники в результате химических реакций диоксида углерода с определенными минералами.
- Также немаловажными источниками являются микробиологические процессы в почвах, особенно в тех зонах, где производится сельскохозяйственная деятельность, и в районах водосбора.
Кроме естественных причин, на уровень жесткости воды также влияют технические факторы. Промышленные и коммунальные сточные воды могут содержать разнообразные загрязнители, которые способствуют вторичному загрязнению водоемов и водоносных горизонтов.
Естественные процессы химической эрозии пород и антропогенные факторы в значительной степени определяют уровень жесткости как питьевой, так и технической воды. Эти показатели могут варьироваться от источника к источнику и подвержены постоянным изменениям:
- Уровень жесткости может увеличиваться из-за испарения влаги с открытых водоемов, что оставляет в воде увеличенную концентрацию солей.
- Этот уровень снижается в результате выпадения осадков, а также при таянии снега и льда.
Высокая концентрация извести в воде, также называемая жесткостью, преимущественно имеет природное происхождение и свойственна подземным источникам, включая артезианские воды. Минеральный элемент вымывается из геологических слоев, когда вода проходит через них по мере своего движения вглубь земной корки. Этот процесс пополняет водный баланс открытых источников, таких как родники и колодцы.
Происходит непрерывный естественный круговорот. Уровень жесткости воды также подвержен сезонным изменениям: он может значительно уменьшаться весной в период снеготаяния и активных дождей, а в другие сезоны, особенно в период засухи, словом повышаться.
Жесткость воды: воздействие на здоровье и сантехнику


Жесткость воды является одним из ключевых свойств, определяющих ее качество для использования в бытовых условиях. Если вода содержит ионы металлов, которые образуют нерастворимые с мылом соли, это приводит к трудностям при вспенивании мыла как при стирке одежды, так и при мытье рук, что создает ощущение недостаточной чистоты. Кроме того, жесткость воды пагубно сказывается на трубах отопительных систем, способствуя образованию отложений накипи, из-за чего в некоторых случаях требуется использование специальных смягчающих веществ.
Жесткость воды формируется в результате наличия растворимых и нерастворимых солей металлов, прежде всего кальция (Ca2+) и магния (Mg2+). Хотя в воде также могут встречаться соли других металлов, таких как стронций (Sr2+), цинк (Zn2+), в исследуемых природных водах (как поверхностных, так и подземных) в заметных концентрациях преобладают именно катионы кальция и магния.
Общая жесткость воды, то есть совокупное содержание растворимых солей кальция и магния, классифицируется как «общая жесткость». Поскольку соли жесткости разнообразны и различаются по молекулярной массе, коэффициент жесткости измеряется в единицах эквивалентной концентрации, в граммах-эквивалентах на литр или миллиграммах-эквивалентах на литр.
По классификации, вода с жесткостью до 4 миллиграмм-эквивалентов на литр считается мягкой; от 4 до 8 миллиграмм-эквивалентов на литр — умеренно жесткой; от 8 до 12 миллиграмм-эквивалентов на литр — жесткой; а превышение 12 миллиграмм-эквивалентов на литр указывает на очень жесткую воду.

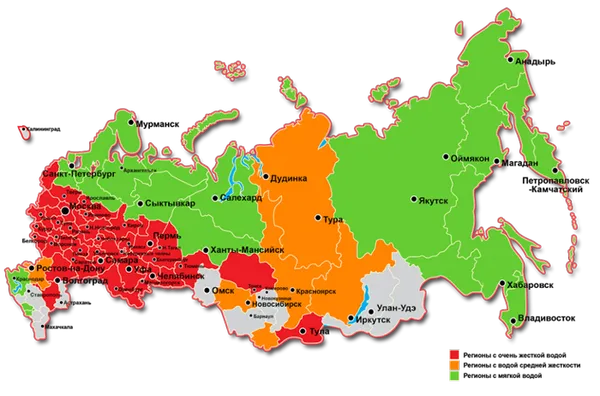
Жесткость как подземных, так и поверхностных вод различается в зависимости от географического расположения в России: мягкие воды в основном наблюдаются в северных частях европейской части страны и Восточной Сибири. На юге и в центре европейской части России, а также в южных регионах Западной Сибири вода чаще имеет жесткий характер. В природных условиях ионы кальция и магния, ответственные за жесткость, попадают в воду вследствие растворения карбонатных минералов под воздействием углекислого газа, а также в процессе выветривания горных пород. Эти ионы также поступают в водоемы в результате микробиологических процессов, происходящих в почвах, а также от сточных вод различных промышленных отраслей. Разнообразие горных пород в зоне водосбора и их характеристики прямо влияют на различия в показателях жесткости воды в разных регионах страны.
Воздействие жесткости на организм
Исследования, направленные на изучение связи между жесткостью воды и сердечно-сосудистыми заболеваниями, продемонстрировали определенные результаты. В результате нескольких научных работ была проведена статистическая корреляция, выявившая обратную зависимость (хотя и не очень сильную) между жесткостью воды и частотой сердечных приступов. Однако в других исследованиях такую зависимость не удалось обнаружить. Это может указывать на то, что основанием негативного влияния на здоровье могут быть не сами соли жесткости, а другие элементы, которые могут присутствовать в воде. Что касается прочих негативных воздействий жесткой воды, то статистические исследования и эксперименты подтвердили их связь с развитием мочекаменной болезни. Тем не менее, не имеется прямой зависимости между жесткостью воды и формированием этой болезни. Важными факторами остаются различные сопутствующие условия, особенно метаболизм неорганических компонентов в организме человека, употребляющего жесткую воду. Так, высокие концентрации солей кальция и магния в питьевой воде могут повышать риск возникновения мочекаменной болезни.
Воздействие увеличенной жесткости воды на оборудование и сантехнические приборы, контактирующие с ее потоками, приводит к следующим последствиям:
- В водопроводных трубах и радиаторах отопления образуются известковые отложения, которые снижают пропускную способность труб и ухудшают теплообменные характеристики системы отопления;
- На нагревательных элементах электротехники, таких как стиральные и посудомоечные машины, а также электрочайники, откладывается известковый налет;
- Жесткая вода непригодна для использования в пищевой промышленности и химическом производстве;
- При стирке с использованием жесткой воды сложно достичь необходимого эффекта отбеливания, и качественно отполоскать белье, что вызовет потускнение ткани: белые вещи приобретают серый оттенок, а цветные теряют свою яркость.
Жесткость воды, обусловленная образованием осадков накипи, оказывает разрушительное воздействие на котельные системы. В России действуют строгие требования к жесткости воды, используемой в котлах электростанций и других крупных промышленных установках. Поэтому применение систем для умягчения воды является необходимым условием.
Способы умягчения воды
Устранение жесткости воды может быть осуществлено с помощью следующих методов:
- Реагентный метод;
- Катионный метод;
- Термический метод.
Часто рекомендуется синтезировать эти методы, применяя реагентный подход для частичного удаления солей жесткости, а оставшиеся соли убирать с помощью катионного обмена, либо сочетать реагентный и термический методы умягчения.
Среди реагентных методов наибольшее распространение получил содово-известковый метод. Он основан на преобразовании растворенных солей Ca2+ и Mg2+ в малорастворимые соединения, такие как CaCO3 и Mg(OH)2, которые образуют осадок.
Катионный метод умягчения воды заключается в пропускании жесткой воды через смесь мелкофракционных веществ (например, синтетических смол или дисульфида углерода). Эти вещества способны замещать катионы натрия Na+ или содержащийся в них водород H+ на катионы кальция Ca2+ или магния Mg2+, растворенные в воде. В пределах этого метода выделяется катионный обмен на Na и обмен на H.
Когда емкость катионного фильтра исчерпывается, она подлежит регенерации. Катионные фильтры, содержащие Na, восстанавливаются с помощью раствора хлорида натрия NaCl, а фильтры H регенерируются с использованием растворов H2SO4 или HCl.
Вода, которая проходит через Na-катионные фильтры, как правило, имеет слегка повышенную щелочность (рН>7), в то время как после H-катионных фильтров — повышенную кислотность (рН<7). В первом случае для подкисления можно использовать дополнительные добавки, а во втором — стоит проводить подщелачивание.
Термический метод умягчения воды наиболее эффективен для воды, предназначенной для паровых котлов, испарителей и парогенераторов. При этом методе вода нагревается до температуры в диапазоне от 105 до 120 °C, что позволяет полностью устранить карбонатную жесткость.

В настоящее время для умягчения бытовой воды наиболее часто используются системы катионного обмена. Благодаря относительно компактным размерам, длительному сроку службы и простоте «дозаправки» при расходах смоляного наполнителя, такие бытовые системы становятся оптимальным выбором как для квартир, так и для загородных домов.
На что влияет жесткость?
Причины, по которым уровень жесткости стандартизирован в ГОСТе, гораздо серьезнее, чем простое бытовое неудобство. Специалисты давно отмечают важность поддержания определенного уровня солей жесткости в воде. Как чрезмерная, так и слишком низкая жесткость представляют серьезные риски. Высокая жесткость может привести к следующим последствиям:
- Развитие мочекаменной болезни;
- Проблемы с костями и суставами;
- Патологии желчного пузыря;
- Различные кожные заболевания, такие как сыпь;
- Разрушение естественного жирового слоя на поверхности кожи;
- Дисбактериоз и другие расстройства кишечника;
- Образование перхоти и зуд;
- Сложности с сердечно-сосудистой функцией.
С другой стороны, недостаток жесткости также крайне нежелателен, поскольку это может привести к вымыванию необходимых солей из организма. Этот факт был подтвержден как статистическими данными, так и клиническими исследованиями в различных странах. Однако отрицательные последствия слишком жесткой воды касаются не только потребления, но и функционирования бытовых приборов, водонагревателей и сантехники. Важно отметить, что слишком мягкая вода также может быть опасной с точки зрения промышленности, технологий и бытового использования. Например, ряд исследований показал, что коррозия металлических труб может происходить быстрее в кислой воде с низким содержанием щелочи.
Поэтому компании-поставщики электроэнергии и водоснабжения стараются сбалансировать химический состав подаваемой воды. Для задач, таких как садоводство, мытье полов, уборка дворов и дорог, а также для целей пожаротушения степень жесткости, как правило, не является критичной. Тем не менее, высокая жесткость приводит к таким проблемам, как:
- Увеличение расхода мылосодержащих и чистящих средств;
- Формирование мыльных осадков, которые не удаляются водой;
- Образование накипи;
- Реакции минералов и солей с полезными веществами, что может приводить к образованию нежелательных промежуточных продуктов (это особенно важно не только в промышленности, но и в лабораторных исследованиях или аналоговой фотографии).
Виды жесткости
Общая жесткость
Общая жесткость воды объединяет такие понятия, как временная и постоянная жесткость. Постоянная жесткость рассчитывается на основе концентрации соли, которые сохраняют свое состояние в растворенном виде независимо от кипячения. Временная жесткость обусловлена наличием веществ, которые могут покидать жидкость и гораздо легче переходят в твердую фазу. При этом они могут практически полностью осаждаться:
- Накипь;
- Осадок, напоминающий хлопья;
- Пленки на поверхности воды.
Карбонатная жесткость
Карбонатной жесткостью называется уровень жесткости, обусловленный присутствием солей кальция и магния. Эти соли при кипячении образуют осадок и выделяют углекислый газ. Правильная кипячение жидкости может значительно уменьшить количество карбонатов. Наиболее эффективным методом в данном случае является получение дистиллированной воды, однако такой подход имеет свои недостатки.
Некарбонатная жесткость
Постоянная жесткость, или некарбонатная, вызвана наличием таких солей, как:
- Фосфаты;
- Силикаты;
- Сульфаты;
- Хлориды;
- Нитраты.
Указанные соли не подвергаются разложению, даже если воду кипятить долго. Эта проблема требует более сложных и специализированных решений. Постоянная жесткость встречается в природных морских водах, океанах и в некоторых случаях в грунтовых и пресных водах, и затрудняет их использование. Некарбонатная жесткость может быть рассчитана как разница между общей и карбонатной жесткостью. Для водопроводной воды она обычно колеблется между 1,5 и 2,5 мг/л.
Качество котловой воды, использующейся в котельных системах, регулируется гораздо более строгими нормами и всегда проверяет содержание различных веществ в воде.
Степени жесткости воды
Жесткость может выражаться в трех типах значений: градусах, миллиграммах на эквивалент и эквивалент начинают. Например, максимально мягкая вода имеет такое значение:
- Не более 4 градусов;
- Или максимально 1,5 эквивалентных мг;
- И не более 70 ppm.
Умеренно жесткая вода имеет следующие стандарты:
- Показатель от 9 до 12 градусов;
- Содержание солей в диапазоне от 4 до 8 эквивалентных мг;
- Общий эквивалент от 140 до 210 ppm.
Наиболее жесткая вода имеет жесткость в диапазоне от 23 до 34 градусов, с содержанием неорганических соединений не менее 12 мг эквивалентов. Значение ppm в этом случае может превышать 210 единиц, максимальная жесткость достигает до 320 единиц.
На практике, как правило, предпочитают использовать более мягкую воду.
Какой бывает жесткость воды

Жесткость делится на три основных типа в зависимости от состава воды: химический и физический состав могут существенно варьировать. Рассмотрим подробнее эти три известных типа:
- Временная жесткость (карбонатная) определяется наличием гидрокарбонатов и карбонатов магния и кальция. Устранение временной жесткости осуществляется путем кипячения. При нагревании соли магния и кальция выделяют углекислый газ, после чего выпадают в осадок, который можно удалить фильтрацией.
- Постоянная жесткость (некарбонатная) включает в себя соли металлов, такие как сульфаты, нитраты, фосфаты, хлориды и силикаты. Устранить постоянную жесткость при кипячении не удается. Для ее удаления требуются альтернативные методы.
- Общая жесткость, представляющая собой суммарное значение как временной, так и постоянной жесткости воды. Этот показатель характеризует содержание всех солей щелочноземельных металлов, включая карбонаты, сульфаты, гидрокарбонаты и фосфаты. Исходя из особенностей, общем уровне жесткости также нужно применять более сложные методы.
Измерение жесткости воды
С января 2014 года в России официальный ГОСТ вводит измерение жесткости воды в градусах жесткости — °Ж. Однако на практике используются и другие единицы измерения, такие как моль/м³ (моль на кубический метр) и мг-экв/л (миллиграмм-эквивалент на литр). В разных странах также могут применяться иные единицы измерения, например, степь жесткости в немецких или французских системах.
Степень жесткости определяется как концентрация солей щелочноземельных металлов и выражается в 0,5 миллимоля на литр или 1 мг-экв/л. Кроме того, результаты анализов часто предоставляются в единицах массы, а не объема, что обусловлено изменением плотности воды под воздействием растворов или изменения температуры.
Полезная информация! Значение жесткости в 1 мг-экв/л соответствует 20,04 мг ионизированного свободного кальция Ca2+ или 12,16 мг магния Mg2+.
Нормы и возможные концентрации жесткости воды

Нормы жесткости для питьевой воды в Российской Федерации установлены на уровне не более 7 градусов или мг-экв/л. Если значение превышает этот предел, такая жидкость уже не рекомендуется для питья и приготовления пищи, а также для прочих бытовых нужд.
Вода может быть классифицирована по жесткости следующим образом:
- Очень мягкая: значение жесткости — до 1,5 °Ж.
- Мягкая: жесткость составляет от 1,5 до 4 мг-экв/л.
- Средней жесткости: показатель жесткости от 4 до 8 °Ж.
- Жесткая: жесткость составляет от 8 мг-экв/л до 12.
- Очень жесткая: такая вода оценивается, если её жесткость превышает 12 °Ж.
Наивысшее содержание солей жесткости чаще наблюдается в подземных источниках, в которых это значение может достигать 8-10 °Ж. В океанах жесткость в среднем составляет 65-70 мг/экв/л, а в морских водах это значение может увеличиваться до 130 мг/экв/л. Наименьшая концентрация солей магния и кальция, как правило, фиксируется в северных регионах.
Важно! Вода, которая одновременно является слишком жесткой и слишком мягкой, может оказаться не полезной для здоровья. Жесткость ниже 1,5 мг-экв/л может нарушить кислотно-щелочной баланс организма, повышая риск коррозии водопроводных труб, а также не подходит для стирки с использованием мыльных растворов.
Как измерить и определить допустимую или повышенную жесткость – методы

Вы можете определить уровень жесткости воды тремя способами:
- Наиболее надежный и точный — это заказать лабораторный анализ. В процессе исследования образца воды будут определены химические вещества, благодаря чему вы получите не только общий показатель жесткости, но и состав микроэлементов, включая их концентрацию. Таким образом, этот анализ рекомендуется проводить владельцам частных домов, особенно при организации водоснабжения от колодцев или скважин, перед установкой систем фильтрации.
- Быстрый и доступный для большинства — использование тестов в виде бумажной полоски. Такой тест на жесткость просто опускается в воду, после чего нужно подождать, пока не изменится цвет индикатора, нанесенного на поверхность! Активный реагент взаимодействует с жидкостью и показывает уровень примесей. Однако есть нюансы, включая сложность интерпретации и довольно низкую точность таких методов.

- Самостоятельный метод — это простое химическое испытание. Вам потребуется два одинаковых мерных стакана, в каждый из которых добавляют по одному грамму хозяйственного мыла (с содержанием активного вещества не менее 72%). Затем в один стакан заливается подогретая дистиллированная вода, а во второй — водопроводная. В первом случае уровень воды должен составить 7 см, во втором — наливать нужно до того момента, пока не появится мыльная пена. После этого измеряется количество добавленной воды, где каждые 1 см раствора эквивалентен двум °dH.
Какая должна быть оптимальная жесткость воды – нормы
Нет единого критерия для жесткости воды, потому что нет общепринятых единиц измерения. Однако для России в 2014 году были утверждены стандарты жесткости, указанные в ГОСТ 31865-2012. Внутри документа данный показатель обозначается в градусах и определяется как °Дж. Это значение равняется одному мг-экв/л. Давайте ознакомимся с таблицей норм, действующих в России и, для сравнения, в Соединенных Штатах:
Представленные пределы в России в мг-экв/л.
Как видно, российские нормы значительно мягче. Это приводит к тому, что бытовая техника, произведенная в США, подвергается гораздо меньшему количеству проблем в сравнении с нашими трубопроводами.
Сравнение с европейскими нормами, например, в Германии, также подчеркивает эту проблему — в России требования по жесткости воды более гибкие, что позволяет большинству водопроводной воды минимально соответствовать стандартам.

Тем не менее, употреблять такую воду не рекомендуется. Поэтому игнорировать существующие стандарты не стоит; по заботе о здоровье ваших близких лучше обратиться в компанию «Домашняя вода», которая предлагает полный спектр услуг по установке систем фильтрации.
Нормы для питьевой воды
Показатели жесткости для питьевой воды регулируются не только ГОСТом, но также рекомендациями Всемирной организации здравоохранения и санитарно-эпидемиологическими нормами (СанПиН). В соответствии с предписаниями ВОЗ одно литр питьевой воды не должен содержать более 30 мг магния и 80 мг кальция, однако СанПиН 2.1.4.1074-01 устанавливает на уровень до 50 мг магния, при этом содержание солей кальция не нормируется. Вместо этого акцентируется внимание на общей жесткости, которая должна составлять до 7 градусов.

SF-mix Clack до 0,8 м3/ч

SF-mix Runxin до 0,8 м3/ч

SF-mix ручной до 0,8 м3/ч












